探针变性
将探针在 75℃恒温水浴中温育 5 min,立即置 0℃,5~10 min,使双链 DNA 探针变性。
标本变性
(1)将制备好的染色体玻片标本于 50℃培养箱中烤片 2~3 h。(经 Giemsa染色的标本需预先在固定液中退色后再烤片)。
(2)取出玻片标本,将其浸在 70~75℃的体积分数 70% 甲酰胺/2×SSC 的变性液中变性2~3 min。
(3)立即按顺序将标本经体积分数 70%、体积分数 90%和体积分数 100%冰乙醇系列脱水,每次 5 min,然后空气干燥。
杂交
将已变性或预退火的 DNA 探针 10 μL 滴于已变性并脱水的玻片标本上,盖上 18×18 盖玻片,用 Parafilm 封片,置于潮湿暗盒中 37℃杂交过夜(约 15~17 h)。由于杂交液较少,而且杂交温度较高,持续时间又长,因此为了保持标本的湿润状态,此过程在湿盒中进行。
洗脱
此步骤有助于除去非特异性结合的探针,从而降低本底。
(1) 杂交次日,将标本从 37℃温箱中取出,用刀片轻轻将盖玻片揭掉。
(2) 将已杂交的玻片标本放置于已预热 42~50℃的体积分数 50%甲酰胺/2×SSC 中洗涤3 次,每次 5 min。
涉及的仪器耗材
(1) 在已预热 42~50℃的 1×SSC 中洗涤 3 次,每次 5 min。
(2) 在室温下,将玻片标本于 2×SSC 中轻洗一下。
(3) 取出玻片,自然干燥。
(4) 取 200 μL 复染溶液(PI/antifade 或 DAPI/antifade 染液)滴加在玻片标本上,盖上盖玻片。
杂交信号的放大(适用于使用生物素标记的探针)
(1) 在玻片的杂交部位加 150 μL 封闭液 I,用保鲜膜覆盖,37℃温育 20min。
(2) 去掉保鲜膜,再加 150 μL avidin-FITC 于标本上,用保鲜膜覆盖,37℃继续温育 40 min。
(3) 取出标本,将其放入已预热 42~50℃的洗脱液中洗涤 3 次,每次 5 min。
(4) 在玻片标本的杂交部位加 150 μL 封闭液 II,覆盖保鲜膜,37℃温育 20 min。
(5) 去掉保鲜膜,加 150 μL antiavidin 于标本上,覆盖新的保鲜膜,37℃温育 40 min。
(6) 取出标本,将其放入已预热 42~50℃的新洗脱液中,洗涤 3 次,每次 5 min。
(7) 重复步骤(1)、(2)、(3),再于 2×SSC 中室温清洗一下。
(8) 取出玻片,自然干燥。
(9) 取 200 μL PI/antifade 染液滴加在玻片标本上,盖上盖玻片。
封片
可采用不同类型的封片液。如果封片液中不含有 Mowiol(可使封片液产生自封闭作用),为防止盖片与载片之间的溶液挥发,可使用指甲油将盖片周围封闭。封好的玻片标本可以在-20~-70℃的冰箱中的暗盒中保持数月之久。
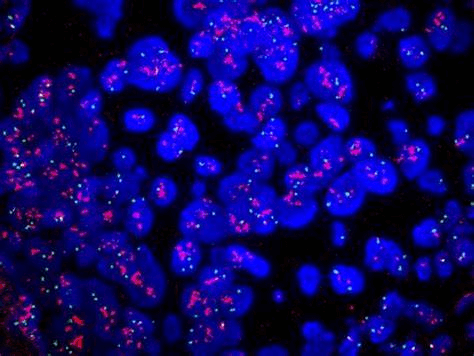
荧光显微镜观察 FISH 结果
先在可见光源下找到具有细胞分裂相的视野,然后打开荧光激发光源,FITC 的激发波长为490 nm。细胞被 PI 染成红色,而经 FITC 标记的探针所在的位置发出绿色荧光。
结果示例:
仪器
恒温水浴锅、培养箱、染色缸、载玻片、Nikon E-400 荧光显微镜、盖玻片、封口膜、200μL移液器、暗盒等。
耗材
甲酰胺、氯化钠、柠檬酸钠、氢氧化钠、吐温 20 、PI、DAPI 、SSC、BAS等;
染色体结构和功能研究:FISH可用于分析染色体结构、特定基因的定位以及染色体上的重复序列等。通过使用荧光探针,可以将特定的DNA序列与染色体上的位置相互对应,从而揭示染色体结构、染色体缺陷和染色体重组等信息。
基因组变异和定量分析:FISH可用于检测染色体重排和基因组的变异,如染色体缺失、重复、转位等。此外,通过将荧光染料与荧光标记的DNA探针结合,可以进行定量分析,如基因拷贝数变异(CNV)的检测。
肿瘤诊断和分子病理学:FISH在肿瘤学中广泛应用,可用于检测肿瘤细胞中的染色体异常和基因缺失。通过对癌症相关基因的FISH分析,可以帮助确定肿瘤类型、预测预后和指导治疗策略。
基因组组装和物种鉴定:FISH可用于帮助解决复杂基因组的组装难题,通过将DNA探针与染色体上的位置相对应,可以辅助进行基因组序列的定位和排序。此外,FISH还可以用于物种鉴定和演化研究。
除了上述应用领域,FISH技术还在生殖医学、胚胎学、植物学和昆虫学等领域得到广泛应用。随着技术的不断进步和创新,FISH在研究和临床实践中的运用还在不断扩展和深化。



我们的地址
杭州术也科技有限公司
浙江省杭州市西湖区西园七路1号绿方科创大厦14层
更多联系方式
座机:(0571) 8876-7926
邮箱:service@vecverse.com


