RNA提取
实验介绍
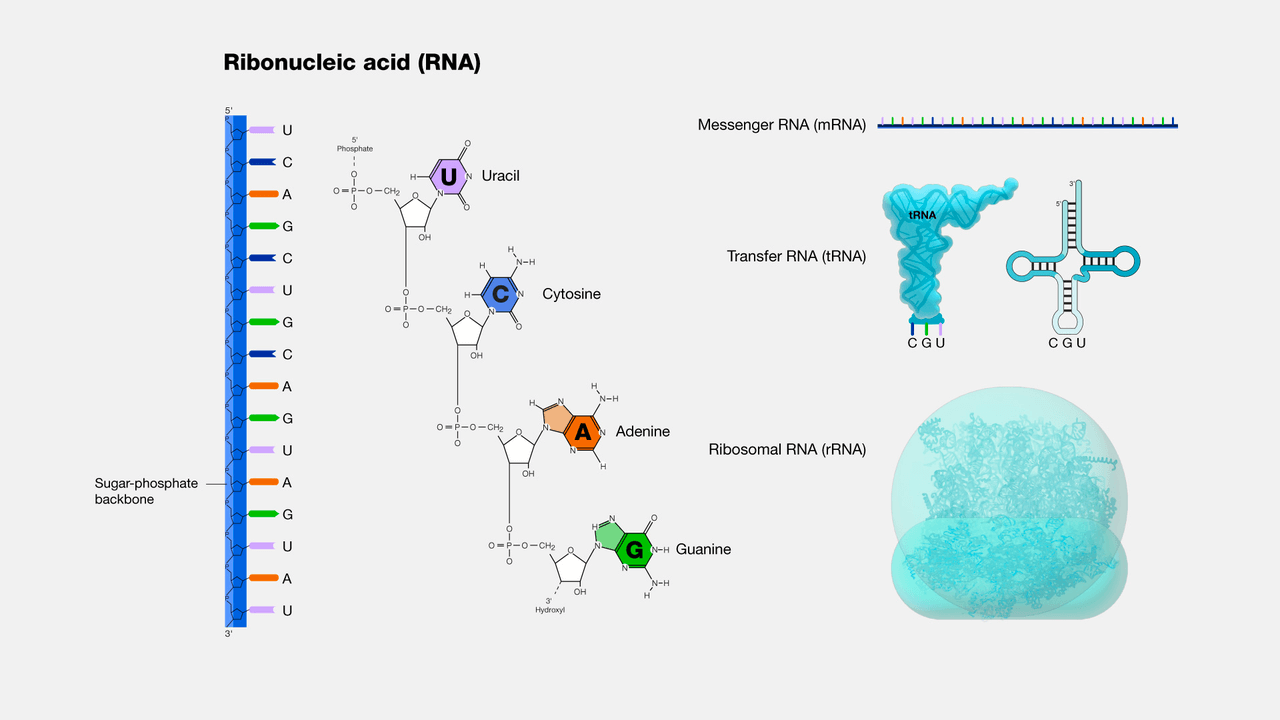
细胞中与蛋白质合成相关的RNA可以分为信使RNA(mRNA)、转运RNA(tRNA)和核糖体RNA(rRNA)三大类。不同组织总RNA提取的实质就是将细胞裂解,释放出RNA,并通过不同方式去除蛋白质、DNA等杂质,最终获得高纯度RNA产物的过程。获得纯度高、完整性好的RNA,对后续的实验至关重要。
相关原理
- 什么是RNA
核糖核酸(Ribonucleic Acid,简称RNA)是一种存在于生物细胞以及部分病毒、类病毒中的遗传信息载体,是由核糖核苷酸通过磷酸二酯键连接而成的长链聚合分子。这种聚合分子,在基因的编码、解码、调节和表达中具有多种生物学作用。与DNA一样,RNA组装成一条核苷酸链,但与DNA不同的是,绝大部分在自然界中发现的RNA是一条折叠在其自身上的单链,而不是一对双链。细胞有机体使用信使RNA(mRNA)来传达指导特定蛋白质合成的遗传信息(使用鸟嘌呤、尿嘧啶、腺嘌呤和胞嘧啶的含氮碱基,由字母G、U、A和C表示)。许多病毒使用RNA基因组编码其遗传信息。RNA包括mRNA(信使RNA)、rRNA(核糖体RNA),rRNA(核糖体RNA),miRNA(小RNA),lncRNA(长链非编码RNA),circRNA(环状RNA)。
- RNA提取实验
- 硫氰酸胍法和Trizol法是动物组织及动物细胞总RNA提取最常用的方法,异硫氰酸胍法操作简单快捷,适用于样本足够大的常规动物组织;Trizol法裂解能力较强,尤其适合小样本及特别难提取的组织。另外Trizol作为一种通用型的裂解试剂,还可以用于植物组织、细菌、真菌等组织的提取。对于含多糖多酚的植物组织如油茶、茶叶、油菜等还可以使用CTAB法进行总RNA的提取。
- 用Trizol 的溶液提取,将总RNA与 DNA 和蛋白质分离。Trizol 是一种酸性溶液,含有硫氰酸胍 (GITC)、苯酚和氯仿。GITC 不可逆地使蛋白质和 RNase 变性。随后进行离心。在酸性条件下,总 RNA 保留在上层水相中,而大部分 DNA 和蛋白质保留在中间相或下层有机相中。然后通过用异丙醇沉淀回收总 RNA。RNase 酶可以通过加入吡咯碳酸二乙酯 (DEPC) 来灭活。
- 相关试剂的作用:
- 苯酚的主要作用是裂解细胞,使细胞中的蛋白,核酸物质解聚得到释放。苯酚虽可有效地变性蛋白质,但不能完全抑制RNA酶活性,因此Trizol中还加入了8-羟基喹啉、异硫氰酸胍、β-巯基乙醇等来抑制内源和外源RNase(RNA酶)。
- 异丙醇通过-OH的疏水作用使得RNA 或者DNA链中的亲水基团受到保护,等同于沉淀。
- 氯仿一方面变性蛋白质,另一方面加入水相和有机相的分离。下层,苯酚-氯仿相,上层是水相,中间为蛋白相。
- 75% 乙醇是起到洗涤的作用,一方面却可以溶解一些沉淀中可能的有机无杂质,另一方面可以洗掉异丙醇、氯仿试剂,还可以溶解一部分蛋白质。
- 其他
- 经典Trizol法会选择性丢失低GC比的miRNA。
- DEPC并不是万能的,尤其是无法处理含有Tris、HEPES等含胺类的溶液,除非加到很高的浓度。
实验流程
以下实验流程为参考,请严格按照试剂盒的说明书操作
- 材料的处理
- 组织:每 100 毫克新鲜组织加入 1 毫升 TRIzol 试剂,使用无菌手术刀在冰上切碎,并用无菌匀浆器或其他设备匀浆。
- 细胞:如果是细胞培养物,应在从培养箱中取出后立即进行处理。细胞在室温(15-25 ºC)下以 1000rpm 离心5 分钟,然后丢弃上清液或从单层生长的细胞中去除培养基,用预冷PBS洗一次。每 1 × 10<7> 细胞加入 1 ml Trizol 试剂。
- 提取流程
4°C 预冷离心机
将组织或细胞裂解液转移到 1.5毫升无RNA酶EP管中。置冰上,静置 5 分钟。
每管加入200ul氯仿,充分混合后冰上静置10分钟,使核蛋白复合物完全解离。
在 4°C 下以 13000 rpm离心 15 分钟。期间,取一新EP管,加入500ul异丙醇,冰上预冷。
离心后,将上层水相 (约500 ul) 转移到该新的 EP管中。
冰上静置,酒精沉淀10min。
离心, 13000 rpm, 10 分钟。
去除上清液。用 1ml 75% 乙醇洗涤 RNA 沉淀一次。
12000rpm离心 5 分钟。
去掉上清,风干或真空干燥 RNA 沉淀 5-10 分钟。
将 RNA 溶解在30-50ul DEPC 处理过的去离子水中(需根据RNA沉淀的量加水溶解)。
进行分光光度分析以确定样品浓度和纯度。
- 注意事项
避免污染
为避免RNase等污染,可以在操作前仔细清洁实验平台、试剂盒、器皿和工具等,并使用经清洗的试剂和器皿。此外,应该尽可能快地进行样品提取,以减少RNA降解和污染的可能性。
明确目的和选择合适的方法
不同的样本类型有不同的组织结构和特征,因此需要根据实验目的和样本类型选择合适的RN提取方法。
优化样品破碎步骤
样品破碎对RNA提取至关重要。不同样品类型需要不同的破碎方法,如高压均质机、超声波等。在破碎过程中,需要注意破碎时间和功率控制,以避免过度破碎导致RNA的降解。细胞破碎方法:超声波法、高压均质法、玻璃珠法等都是常用的细胞破碎方法。
温度控制
RNA在高温下易于分解,因此在提取RNA时要控制好温度。在冷冻样品之前,通常建议在低温环境中培养细胞或收集组织,以最大程度地保护RNA。
RNA/DNA保存
RN应该储存在-80℃冰箱中,以避免降解和污染。在长期储存之前,建议进行浓缩,并将RNA用RNase-free水稀释至合适的浓度。
仪器耗材
试剂
氯仿,苯酚,异丙醇溶液,无RNA酶水,75%乙醇。
仪器
移液枪,超净台,涡旋器,冷冻离心机
运用
通过总RNA提取可获得高纯度及高质量的总RNA,可用于实时荧光定量PCR、Northern blot、microRNA检测、芯片分析, DNA文库构建,基因克隆等实验。



已经到底啦
交个朋友吧
我们的地址
杭州术也科技有限公司
浙江省杭州市西湖区西园七路1号绿方科创大厦14层
更多联系方式
座机:(0571) 8876-7926
邮箱:service@vecverse.com


